
中国科学院上海有机化学研究所-生物医药快讯-2025-03
2025年3月FDA批准2种新药,具体如下:
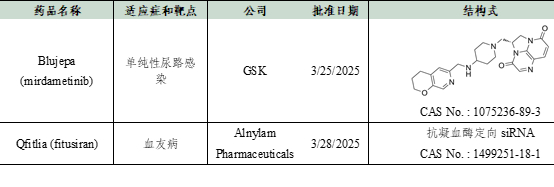
数据来源:Cortellis - Clarivate Analytics
结构式:
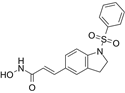
CAS No.:1338320-94-7
靶点/机制:组蛋白去乙酰化酶抑制剂;
可能的适应症:结直肠癌;实体瘤;
公司/组织:台北医学大学,Formosa Pharmaceuticals,安邦生物;
结构式:
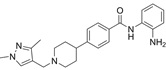
CAS No.:934828-12-3
靶点/机制:组蛋白去乙酰化酶抑制剂;
可能的适应症:结肠直肠癌;霍奇金病;肝癌;外周T细胞淋巴瘤;
公司/组织:阿斯利康,Cancer Research UK; IngenOx Therapeutics;
结构式:
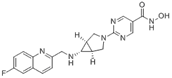
CAS No.:1256448-47-1
靶点/机制:组蛋白去乙酰化酶抑制剂;
可能的适应症:淋巴瘤;多发性骨髓瘤;鼻咽癌;实体瘤;
公司/组织:Chroma Therapeutics,Viracta Therapeutics;
结构式:
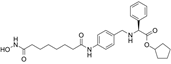
CAS No.:914382-60-8
靶点/机制:组蛋白去乙酰化酶抑制剂;
可能的适应症:炎症;
公司/组织:Cardiff University,Chroma Therapeutics;
结构式:
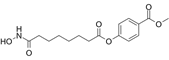
CAS No.:946150-57-8
靶点/机制:组蛋白去乙酰化酶抑制剂;
可能的适应症:基底细胞癌;皮肤T细胞淋巴瘤;鳞状细胞癌;
公司/组织:Medivir AB,Shape Pharmaceuticals;
结构式:
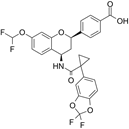
CAS No.:1918143-53-9
靶点/机制:囊性纤维化跨膜传导调节器调节剂;
可能的适应症:囊性纤维化;
公司/组织:艾伯维,Galapagos NV;
结构式:
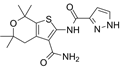
CAS No.:1654725-02-6
靶点/机制:囊性纤维化跨膜传导调节器调节剂;
可能的适应症:囊性纤维化;
公司/组织:Cystic Fibrosis Foundation Therapeutics,Galapagos NV;
结构式:
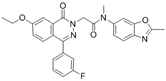
CAS No.:1628416-28-3
靶点/机制:囊性纤维化跨膜传导调节器调节剂;
可能的适应症:囊性纤维化;
公司/组织:Flatley Discovery Lab;
结构式:
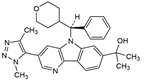
CAS No.:1800340-40-2
靶点/机制:BET抑制剂;
可能的适应症:骨髓瘤;
公司/组织:百时美施贵宝;
结构式:
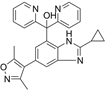
CAS No.:1637771-14-2
靶点/机制:BET 溴结构域抑制剂;
可能的适应症:恶性黑色素瘤;实体瘤;
公司/组织:吉列德;
数据来源:Cortellis - Clarivate Analytics
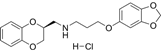
结构式:
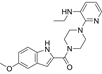
CAS No.:136816-75-6
靶点/机制:RNA定向DNA聚合酶抑制剂;
可能的适应症:HIV感染;
公司/组织:Pharmacia;
终止(discontinued)时间:2001;
终止原因:未知
结构式:
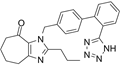
CAS No.:153804-05-8
靶点/机制:血管紧张素II受体拮抗剂;
可能的适应症:动脉粥样硬化;糖尿病肾病;肾小球肾炎;
公司/组织:Kotobuki Seiyaku,Boryung Pharmaceutical,Daiichi Sankyo;
终止(discontinued)时间:2013;
终止原因:未知
结构式:
CAS No.:958002-33-0
靶点/机制:非结构蛋白5B (NS5B)聚合酶抑制剂;
可能的适应症:丙型肝炎;
公司/组织:百时美施贵宝;
终止(discontinued)时间:2014;
终止原因:未知
结构式:
CAS No.:774531-07-6
靶点/机制:Xa因子抑制剂;
可能的适应症:深静脉血栓;栓塞;
公司/组织:赛诺菲;
终止(discontinued)时间:2008;
终止原因:商业原因
结构式:
CAS No.:137275-80-0
靶点/机制:5-HT1A 受体激动剂;
可能的适应症:焦虑症;失眠症;肠易激综合征;重度抑郁症;
公司/组织:Mitsubishi Tanabe Pharma;
终止(discontinued)时间:2014;
终止原因:未知
信息来源:Cortellis - Clarivate Analytics
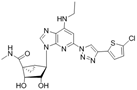
靶点/机制:A3R激动剂;
可能的适应症:疼痛;
公司/组织:National Institutes of Health;
最早出现preclinical data时间:2015/7;
来源文献:Crane, Steven et al., ACS Med Chem Lett, 2015, 6, 804.
结构式:
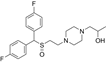
CAS No.:1627576-76-4
靶点/机制:DAT拮抗剂;
可能的适应症:兴奋剂滥用;
公司/组织:National Institutes of Health;
最早出现preclinical data时间:2023/12;
来源文献:Ku T C et al, J Med Chem, 2023, 67, 709.
结构式:

CAS No.:2801627-78-9
靶点/机制:P2Y14R 拮抗剂;
可能的适应症:炎症;
公司/组织:National Institutes of Health;
最早出现preclinical data时间:2023/7;
来源文献:Wen Z et al., J Med Chem, 2023, 66, 9076.
结构式:
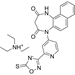
CAS No.:2840581-32-8
靶点/机制:P2X4受体拮抗剂;
可能的适应症:缺血性卒中;
公司/组织:NIDDK(国家糖尿病、消化和肾脏疾病研究所);
最早出现preclinical data时间:2022/10;
来源文献:Toti KS et al., J Med Chem, 2022, 65, 13967.
结构式:
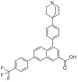
CAS No.:2370976-04-6
靶点/机制:P2Y14拮抗剂;
可能的适应症:哮喘;
公司/组织:NIDDK(国家糖尿病、消化和肾脏疾病研究所);
最早出现preclinical data时间:2020/9;
来源文献:Young-Hwan Jung et al., J Med Chem, 2020, 63(17), 9563.
结构式:
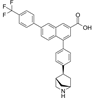
CAS No.:2801625-42-1
靶点/机制:P2Y14R拮抗剂;
可能的适应症:多发性骨髓瘤;
公司/组织:加利福尼亚大学;
最早出现preclinical data时间:2022/2;
来源文献:Wen Z et al., J Med Chem, 2022, 65, 3434.
结构式:
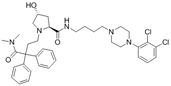
CAS No.:2833692-02-5
靶点/机制:D3 receptor拮抗剂;μ opioid receptor激动剂;
可能的适应症:炎症;神经痛;
公司/组织:National Institute on Drug Abuse;
最早出现preclinical data时间:2023/10;
来源文献:Alessandro Bonifazi et al., J Biol Chem, 2023, 66, 10304.
结构式:
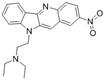
CAS No.:214467-41-1
靶点/机制:CDC42 抑制剂;
可能的适应症:乳腺癌;
公司/组织:美国国立卫生研究院;
最早出现preclinical data时间:2022/10;
来源文献:Samar Sayedyahossein et al., Sci Rep, 2022, 12, 17372.
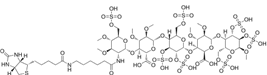
结构式:
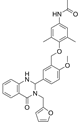
CAS No.:1338824-21-7
靶点/机制:TSHR 拮抗剂;
可能的适应症:格雷夫斯病;
公司/组织:National Human Genome Research Institute;
最早出现preclinical data时间:2014/1;
来源文献:Susanne Neumann et al., Endocrinology, 2014, 155, 310.
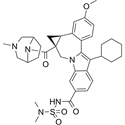
结构式:
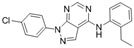
CAS No.:393785-04-1
靶点/机制:CDC42 抑制剂;
可能的适应症:乳腺癌;
公司/组织:美国国立卫生研究院;
最早出现preclinical data时间:2022/10;
来源文献:Samar Sayedyahossein et al., Sci Rep, 2022, 12, 17372.
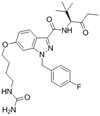
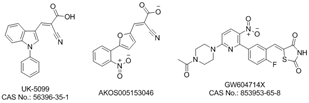
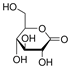
附件下载: