
中国科学院上海有机化学研究所-生物医药快讯-2025-02
2025年2月FDA批准2种新药,具体如下:
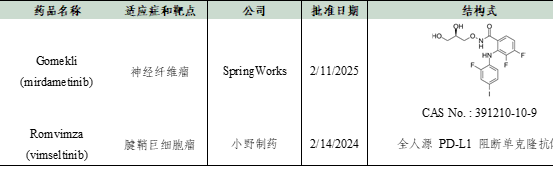
数据来源:Cortellis - Clarivate Analytics
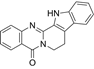
结构式:
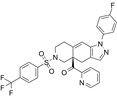
CAS No.:1496508-34-9
靶点/机制:糖皮质激素受体拮抗剂;
可能的适应症:肌萎缩性脊髓侧索硬化症;
公司/组织:Corcept Therapeutics;
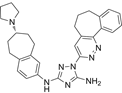
结构式:
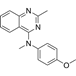
CAS No.:827031-83-4
靶点/机制:微管蛋白聚合抑制剂;血管破坏剂;
可能的适应症:脑转移瘤;胶质母细胞瘤;
公司/组织:EpiCept Corporation;
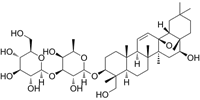
结构式:
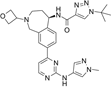
CAS No.:2247614-80-6
靶点/机制:Bruton's tyrosine kinase (BTK) 抑制剂;
可能的适应症:多发性硬化症;
公司/组织:Biogen;
结构式:
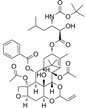
CAS No.:849213-15-6
靶点/机制:微管稳定剂;
可能的适应症:乳腺癌;胶质母细胞瘤;
公司/组织:Tapestry Pharmaceuticals;
结构式:
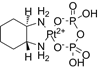
CAS No.:1339960-28-9
靶点/机制:载脂蛋白刺激剂;细胞凋亡刺激剂;
可能的适应症:恶性胸腺瘤;非小细胞肺癌;前列腺癌;
公司/组织:EMD Serono;
结构式:
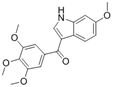
CAS No.:613679-11-1
靶点/机制:血管生成抑制剂;微管蛋白聚合抑制剂;
可能的适应症:头颈癌;
公司/组织:SynCore Biotechnology;
结构式:
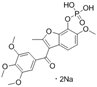
CAS No.:945771-96-0
靶点/机制:微管蛋白抑制剂;
可能的适应症:卵巢癌;
公司/组织:Bionomics;
结构式:
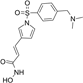
CAS No.:864814-88-0
靶点/机制:组蛋白去乙酰化酶抑制剂;
可能的适应症:实体瘤;
公司/组织:AnBogen Therapeutics; Formosa Pharmaceuticals;
结构式:
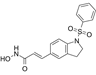
CAS No.:1834513-65-3
靶点/机制:组蛋白去乙酰化酶抑制剂;
可能的适应症:恶性黑色素瘤;实体瘤;
公司/组织:OnKure Therapeutics;
结构式:
CAS No.:1338320-94-7
靶点/机制:组蛋白去乙酰化酶抑制剂;
可能的适应症:实体瘤;
公司/组织:AnBogen Therapeutics; Formosa Pharmaceuticals;
数据来源:Cortellis - Clarivate Analytics
结构式:
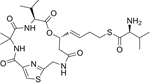
CAS No.:137159-92-3
靶点/机制:谷氨酸受体拮抗剂;
可能的适应症:脑损伤;中风;
公司/组织:CeNeS Pharmaceuticals;
终止(discontinued)时间:2001/11;
终止原因:疗效不足
结构式:
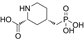
CAS No.:110347-85-8
靶点/机制:谷氨酸受体拮抗剂;NMDA 受体拮抗剂;
可能的适应症:脑损伤;脑血管疾病;认知障碍;
公司/组织:诺华;
终止(discontinued)时间:2000;
终止原因:缺乏疗效以及在临床试验中发现可能存在神经毒性
结构式:
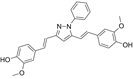
CAS No.:1019110-87-2
靶点/机制:KCNQ 钾通道激动剂;NMDA 受体拮抗剂;阿片受体激动剂;
可能的适应症:糖尿病神经病变;神经性疼痛;
公司/组织:CNSBio,Relevare Pharmaceuticals;
终止(discontinued)时间:2010;
终止原因:未知
结构式:
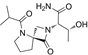
CAS No.:2591344-26-0
靶点/机制:NMDAR调节剂; 蛋白变构调节剂;
可能的适应症:创伤后应激障碍;阿片类依赖;
公司/组织:Aptinyx,耶鲁大学;
终止(discontinued)时间:2022;
终止原因:疗效不足
结构式:
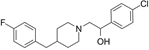
CAS No.:119431-25-3
靶点/机制:α-肾上腺素能受体激动剂;谷氨酸受体拮抗剂;
可能的适应症:肌萎缩侧索硬化症;颅脑创伤;多发性硬化症;
公司/组织:Sanofi-Synthelabo;
终止(discontinued)时间:2002/6;
终止原因:未知
信息来源:Cortellis - Clarivate Analytics
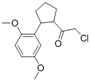
CAS No.:900137-36-2
NF764结构式
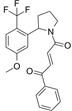
靶点/机制:β-catenin (CTNNB1) 降解剂;
可能的适应症:肿瘤;
公司/组织:加利福尼亚大学;
最早出现preclinical data时间:2024/6;
来源文献:Flor A. Gowans et al., JACS, 2024, 146, 16856.
结构式:
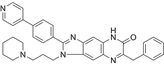
CAS No.:1265822-30-7
靶点/机制:ITK (IL-2 诱导型 T 细胞激酶)抑制剂;
可能的适应症:T细胞白血病;
公司/组织:加利福尼亚大学;
最早出现preclinical data时间:2012/11;
来源文献:Guo W et al, Mol Pharmacol, 2012, 82, 938.
结构式:
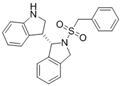
CAS No.:1704699-99-9
靶点/机制:CDC42 GTPases抑制剂;
可能的适应症:肿瘤;
公司/组织:加利福尼亚大学;
最早出现preclinical data时间:2015/4;
来源文献:Jiewen Zhu et al., J Med Chem, 2015, 96, 196.
结构式:
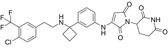
靶点/机制:靶向C2H2锌指转录因子ZBTB11抑制剂;
可能的适应症:胰腺导管腺癌;
公司/组织:加利福尼亚大学;
最早出现preclinical data时间:2024/5;
来源文献:Tran NL et al., bioRxiv, 2024, 10.1101/2024.05.19.594824.
结构式:
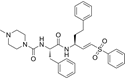
CAS No.:233277-99-1
靶点/机制:半胱氨酸蛋白酶抑制剂;
可能的适应症:Chagas症;
公司/组织:康奈尔大学;
最早出现preclinical data时间:2013/12;
来源文献:Momar Ndao et al., Antimicrob Agents Chemother, 2013, 57(12), 6063.
结构式:
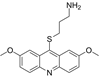
CAS No.:184582-62-5
靶点/机制:Haspin 和 DYRK2 的双重抑制剂;
可能的适应症:多发性骨髓瘤;
公司/组织:加利福尼亚大学;
最早出现preclinical data时间:2010/6;
来源文献:Momar Ndao et al., Antimicrob Agents Chemother, 2013, 57(12), 6063.
结构式:
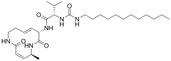
CAS No.:1514925-83-7
靶点/机制:蛋白酶体抑制剂;
可能的适应症:结直肠癌;套细胞淋巴瘤;多发性骨髓瘤;
公司/组织:加利福尼亚大学,Ginkgo Bioworks;
最早出现preclinical data时间:2016/4;
来源文献:André S Bachmann et al., J Biol Chem, 2016, 291, 8350.
结构式:
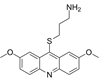
CAS No.:184582-62-5
靶点/机制:Haspin和DYRK2双重抑制剂;
可能的适应症:多发性骨髓瘤;三阴性乳腺癌;
公司/组织:加利福尼亚大学;
最早出现preclinical data时间:2010/6;
来源文献:Cuny GD et al., Bio Med Chem Lett, 2010, 20, 3491.
结构式:
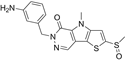
CAS No.:1221186-53-3
靶点/机制:酮酸激酶 M2 (pyruvate kinase M2; PKM2) 激活剂;
可能的适应症:腹泻;多囊肾;
公司/组织:National Institutes of Health;
最早出现preclinical data时间:2012/10;
来源文献:Anastasiou D et al., Nat Chem Biol, 2012, 8(10), 839.
结构式:
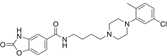
CAS No.:1221408-42-9
靶点/机制:多巴胺 D3 受体拮抗剂;
可能的适应症:创伤后应激障碍;
公司/组织:National Institute on Drug Abuse;
最早出现preclinical data时间:2013/9;
来源文献:Song R et al., Neuropharmacology, 2013, 72, 82.
附件下载: