
中国科学院上海有机化学研究所-生物医药快讯-2024-10
2024年10月FDA批准4种新药,具体如下:
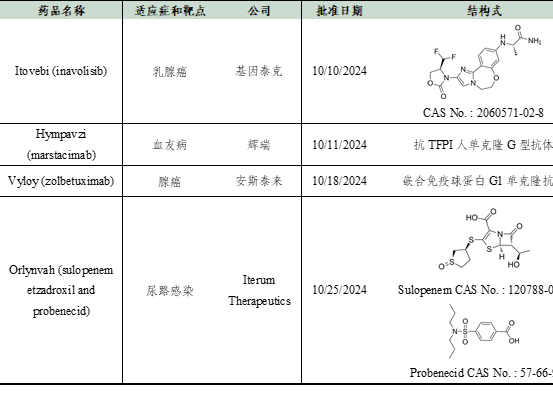
数据来源:Cortellis - Clarivate Analytics
结构式:
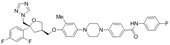
CAS No.:1931946-73-4
靶点/机制:CYP51A1抑制剂;
可能的适应症:曲霉菌属感染; 肺曲霉病;
公司/组织:Pulmocide;
结构式:
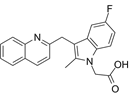
CAS No.:851723-84-7
靶点/机制:前列腺素 D2 受体拮抗剂;
可能的适应症:哮喘;
公司/组织:Oxagen,Atopix Therapeutics;
结构式:
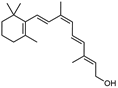
CAS No.:22737-97-9
靶点/机制:酰基转移酶刺激剂;
可能的适应症:先天性盲症;色素性视网膜炎;
公司/组织:QLT,Retinagenix Therapeutics,Novelion Therapeutics;
结构式:
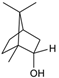
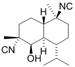
CAS No.:464-43-7
靶点/机制:未知;
可能的适应症:中风;
公司/组织:苏州沪云新药研发公司;
结构式:
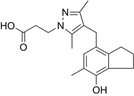
CAS No.:1092551-88-6
靶点/机制:甲状腺激素受体激动剂;
可能的适应症:高脂血症;糖尿病;
公司/组织:Torrent Pharmaceuticals;
结构式:
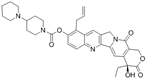
CAS No.:951290-31-6
靶点/机制:DNA拓扑异构酶I抑制剂;低氧诱导因子1抑制剂;
:神经内分泌肿瘤;
公司/组织:海和药物;
结构式:
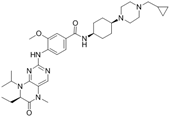
CAS No.:755038-65-4
靶点/机制:Polo样激酶1 (PLK1) 抑制剂;
可能的适应症:急性髓性白血病;
公司/组织:勃林格殷格翰,Oncoheroes Biosciences;
结构式:
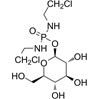
CAS No.:132682-98-5
靶点/机制:烷化剂;DNA 合成抑制剂;
可能的适应症:胰腺癌;
公司/组织:Baxter Oncology,Eleison Pharmaceuticals,MediBIC, Threshold Pharmaceuticals;
结构式:
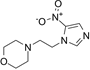
CAS No.:6506-37-2
靶点/机制:DNA 合成抑制剂;
可能的适应症:头颈癌;
公司/组织:Azanta;
结构式:
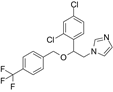
CAS No.:1269726-67-1
靶点/机制:14-α去甲基化酶抑制剂;
可能的适应症:足癣;
公司/组织:Biolab Sanus Farmaceutica;
数据来源:Cortellis - Clarivate Analytics
结构式:
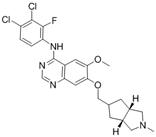
CAS No.:781613-23-8
靶点/机制:多靶点酪氨酸激酶抑制剂;
可能的适应症:非小细胞肺癌;常染色体隐性多囊肾病;
公司/组织:Exelixis; Kadmon Pharmaceuticals;
终止(discontinued)时间:2024/7;
终止原因:未知
结构式:
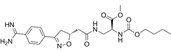
CAS No.:170902-47-3
靶点/机制:GPIIb-IIIa 拮抗剂;
可能的适应症:心血管疾病;外周动脉疾病;
公司/组织:百时美施贵宝;
终止(discontinued)时间:2002;
终止原因:副作用
结构式:
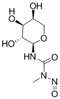
CAS No.:167396-23-8
靶点/机制:未知;
可能的适应症:哮喘;深静脉血栓;缺血性心脏疾病;
公司/组织:N N Blokhin Russian Cancer Research Center;
终止(discontinued)时间:2007/4;
:未知
结构式:
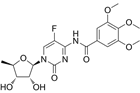
CAS No.:124012-42-6
靶点/机制:胸腺嘧啶酸合成酶抑制剂;
可能的适应症:癌症;
公司/组织:罗氏;
终止(discontinued)时间:2007/3;
终止原因:未知
结构式:
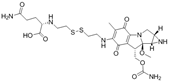
CAS No.:118359-59-4
靶点/机制:DNA 交联剂;
可能的适应症:癌症;
公司/组织:Kyowa Hakko;
终止(discontinued)时间:2006/9;
终止原因:未知
信息来源:Cortellis - Clarivate Analytics
结构式:
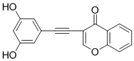
CAS No.:1678539-08-6
靶点/机制:AMPK激动剂;
可能的适应症:Ⅱ型糖尿病;
公司/组织:上海药物所;
最早出现preclinical data时间:2015/8;
来源文献:Zeng HL et al., Acta Pharmaco. Sin, 2015, 36, 343.
结构式:
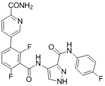
CAS No.:2621401-41-8
靶点/机制:CDK2抑制剂;
可能的适应症:肿瘤;
公司/组织:上海药物所;
最早出现preclinical data时间:2021/4;
来源文献:Lin TT, Eur J Med Chem, 2021, 215, 113281.
结构式:
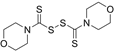
CAS No.:729-46-4
靶点/机制:PDK抑制剂;
可能的适应症:肿瘤;
公司/组织:上海药物所;
最早出现preclinical data时间:2015/11;
来源文献:Wenyi S et al., Cancer Res, 2015, 75, 4923.
结构式:
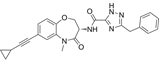
CAS No.: 2416593-55-8
靶点/机制:RIPK1抑制剂;
可能的适应症:脓毒症;
公司/组织:上海药物所;
最早出现preclinical data时间:2022/1;
来源文献:Yang X et al., Angew Chem Int Ed, 2022, 61, e202114922.
结构式:
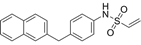
CAS No.:2380228-45-3
靶点/机制:TEADs棕榈酰化口袋共价抑制剂;
可能的适应症:结肠癌;
公司/组织:上海药物所;
最早出现preclinical data时间:2019/11;
来源文献:Lu WC et al., Eur J Med Chem, 2019, 184, 111767.
结构式:
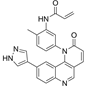
CAS No.:1469988-63-3
靶点/机制:BTK/MNK双激酶抑制剂;
可能的适应症:白血病;淋巴瘤;
公司/组织:合肥物质院;
最早出现preclinical data时间:2019/10;
来源文献:Wu H et al., Leukemia, 2016, 30(1), 173.
结构式:
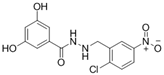
CAS No.:304455-05-8
靶点/机制:ACE2和SRBD1双重抑制剂;
可能的适应症:新冠病毒感染;
公司/组织:上海药物所;
最早出现preclinical data时间:2021/9;
来源文献:Xiong JC et al., Front Chem, 2021, 9, 740702.
结构式:
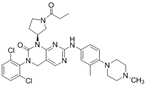
CAS No.:2379886-04-9
靶点/机制:CSF1R拮抗剂;
可能的适应症:肿瘤;
公司/组织:上海药物所;
最早出现preclinical data时间:2018/7;
来源文献:liu YQ et al., Acta Pharmacol Sin, 2018, 39, 1768.
结构式:
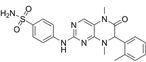
CAS No.:2414484-25-4
靶点/机制:STE20-like protein 1 kinase (MST1) 抑制剂;
可能的适应症:糖尿病;
公司/组织:合肥物质研究院;
最早出现preclinical data时间:2022/9;
来源文献:Wu Y et al., J Med Chem, 2022, 65 (17), 11818.
结构式:
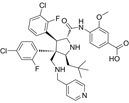
CAS No.:2771313-42-7
靶点/机制:MDM2/4双重抑制剂;
可能的适应症:肿瘤;
公司/组织:上海药物所;
最早出现preclinical data时间:2022/4;
来源文献:Zhang SL et al., J Med Chem, 2022, 65(8), 6207.
附件下载: