
中国科学院上海有机化学研究所-生物医药快讯-2024-09
2024年9月FDA批准5种新药,具体如下:

数据来源:Cortellis - Clarivate Analytics
结构式:
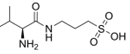
CAS No.:1034190-08-3
靶点/机制:β-淀粉样蛋白 β-amyloid (Aβ) 抑制剂; GABA A 受体激动剂;
可能的适应症:阿尔兹海默症;
公司/组织:Alzheon,BELLUS Health,美国国家老龄化研究所;
结构式:
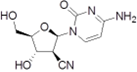
CAS No.:135598-68-4
靶点/机制:DNA 定向 DNA 聚合酶抑制剂;
可能的适应症:急性髓性白血病;
公司/组织:Delta-Fly Pharma,Nippon Shinyaku;
结构式:
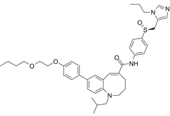
CAS No.:497223-25-3
靶点/机制:CCR2/5 受体拮抗剂;
可能的适应症:非酒精性脂肪性肝炎;
公司/组织:National Institute for Health Research,Takeda;
结构式:
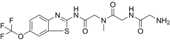
CAS No.:1926203-09-9
靶点/机制:兴奋性氨基酸拮抗剂;谷氨酸释放抑制剂;电压门控钠通道抑制剂;
可能的适应症:强迫症;
公司/组织:Yale University,Biohaven Pharmaceuticals;
结构式:
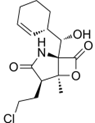
CAS No.:437742-34-2
靶点/机制:蛋白酶体抑制剂;
可能的适应症:胶质母细胞瘤;
公司/组织:Nereus Pharmaceuticals,Celgene;
结构式:
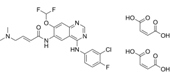
CAS No.:1989592-50-8
靶点/机制:表皮生长因子受体拮抗剂;ERBB 2受体拮抗剂;
可能的适应症:非小细胞肺癌;
公司/组织:华东医药;
结构式:
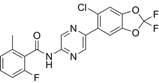
CAS No.:1713240-67-5
靶点/机制:免疫抑制剂;ORAI1蛋白抑制剂;STIM1蛋白抑制剂;
可能的适应症:新冠肺炎;
公司/组织:CalciMedica;
结构式:
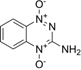
CAS No.:27314-97-2
靶点/机制:II 型 DNA 拓扑异构酶抑制剂;
可能的适应症:宫颈癌;
公司/组织:Merck,SRI International,Teclison;
结构式:
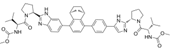
CAS No.:1959593-23-7
靶点/机制:丙肝病毒非结构蛋白 5A (NS5A) 抑制剂;
可能的适应症:丙型肝炎;
公司/组织:东莞HEC太景生物制药,HEC Pharm;
结构式:
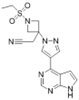
CAS No.:1187594-09-7
靶点/机制:细胞周期蛋白依赖性激酶4/6抑制剂;
可能的适应症:乳腺癌;
公司/组织:吉林四环药业;轩竹药业;
数据来源:Cortellis - Clarivate Analytics
结构式:
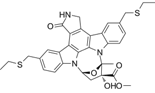
CAS No.:156177-65-0
靶点/机制:丝裂原活化蛋白激酶抑制剂;混合系激酶抑制剂;
可能的适应症:喘;认知障碍;帕金森症;
公司/组织:Cephalon,Kyowa Hakko;
终止(discontinued)时间:2010;
终止原因:疗效不足
结构式:
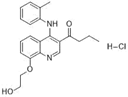
CAS No.:144453-77-0
靶点/机制:质子泵抑制剂;
可能的适应症:消化性溃疡;
公司/组织:ALTANA Pharma; GSK;
终止(discontinued)时间:2008;
终止原因:未知
结构式:
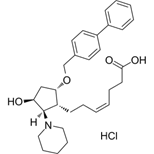
CAS No.:87248-13-3
靶点/机制:血栓素A2受体拮抗剂;
可能的适应症:哮喘;深静脉血栓;缺血性心脏疾病;
公司/组织:Sanofi-Synthelabo;
终止(discontinued)时间:1999;
终止原因:未知
结构式:
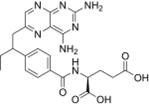
CAS No.:80576-83-6
靶点/机制:四氢叶酸脱氢酶抑制剂;
可能的适应症:癌症;类风湿性关节炎;
公司/组织:SRI International;
终止(discontinued)时间:2000;
终止原因:副作用
结构式:
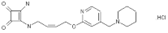
CAS No.:126463-66-9
靶点/机制:组胺 H2 受体拮抗剂;
可能的适应症:十二指肠溃疡;消化性溃疡;
公司/组织: Ikedo Mohando,Taisho Pharmaceutical;
终止(discontinued)时间:2007/8;
终止原因:未知
信息来源:Cortellis - Clarivate Analytics
结构式:
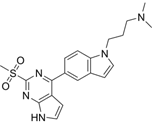
CAS No.:2758411-61-7
靶点/机制:溴域 PHD 指转录因子 (BPTF) 抑制剂;
可能的适应症:白血病;
公司/组织:福建医科大学,上海药物所;
最早出现preclinical data时间:2021/8;
来源文献:Lu T et al.,J Med Chem,2021,64(16),12075.
结构式:
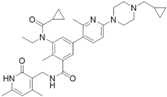
靶点/机制:Zeste同系物增强子2(EZH2)抑制剂;
可能的适应症:B细胞淋巴瘤;
公司/组织:合肥物质研究院;
最早出现preclinical data时间:2021/10;
来源文献:Bin Zhou,J Med Chem,2021. 64 (20),15170.
结构式:
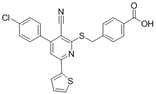
CAS No.:340808-65-3
靶点/机制:KAT2A抑制剂;
可能的适应症:白血病;
公司/组织:上海药物所;
最早出现preclinical data时间:2019/1;
来源文献:Tao HR et al.,RSC Adv,2019,9,4917.
结构式:
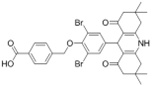
CAS No.:2213926-11-3
靶点/机制:KAT2A抑制剂;
可能的适应症:癌症;
公司/组织:上海药物所;
最早出现preclinical data时间:2018/2;
来源文献:Xiong Huan et al.,Eur J Med Chem.,2018,151,740.
结构式:
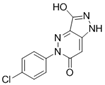
CAS No.:2650350-89-1
靶点/机制:UBA2抑制剂;
可能的适应症:肿瘤;心脏和血管疾病;
公司/组织:上海药物所;
最早出现preclinical data时间:2020/4;
来源文献:YZ Wang et al.,Acta Pharmacol Sin,2020,41(11),1497.
结构式:
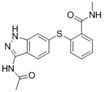
CAS No.:2617376-08-4
靶点/机制:VEGFR2抑制剂;
可能的适应症:癌症;
公司/组织:合肥物质院;
最早出现preclinical data时间:2019/10;
来源文献:ZR Jiang et al.,Acta Pharmacol Sin B,2019,10(3),488.
结构式:
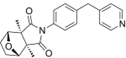
CAS No.:2883709-99-5
靶点/机制:TRIP13抑制剂;
可能的适应症:多发性骨髓瘤;
公司/组织:上海药物所;
最早出现preclinical data时间:2024/1;
来源文献:SF Dong et al.,Bioorg Med Chem Lett,2024,98,129590.
结构式:
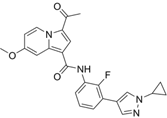
CAS No.:2450965-18-9
靶点/机制:CREBBP抑制剂;
可能的适应症:急性髓性白血病;
公司/组织:广州健康院;
最早出现preclinical data时间:2024/1;
来源文献:Q Xiang et al.,Bioorg Chem,2024,142,106950.
结构式:
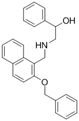
CAS No.:892569-53-8
靶点/机制:PRMT5抑制剂;
可能的适应症:癌症;
公司/组织:上海药物所,睿智医药;
最早出现preclinical data时间:2017/5;
来源文献:Ye Y et al.,Org Biomol Chem,2017,15 (17),3648.
结构式:
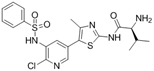
CAS No.:1807550-80-6
靶点/机制:PI3Kδ抑制剂;
可能的适应症:B细胞恶性肿瘤;
公司/组织:合肥物质院;
最早出现preclinical data时间:2016/5;
来源文献:XC Liu et al.,Oncotarget,2016,7(22),32641.
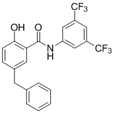
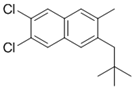
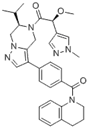
附件下载: